Los hongos que matan a 1,6 millones de personas cada año
Hongos, mohos y levaduras, son patógenos que matan a 1,6 millones de personas cada año, y tenemos pocas defensas contra ellos
Era la cuarta semana de junio de 2020, y la mitad de la segunda ola de la pandemia de COVID en los EE.UU. Los casos habían superado los 2,4 millones; las muertes por el nuevo coronavirus se acercaban a 125.000. En la oficina de su casa en Atlanta, Tom Chiller levantó la vista de sus correos electrónicos y se pasó las manos por la cara y la cabeza afeitada.
Chiller es médico y epidemiólogo y, en tiempos normales, jefe de sucursal de los Centros para el Control y la Prevención de Enfermedades de EE. UU., A cargo de la sección que monitorea las amenazas para la salud de hongos como mohos y levaduras. Había dejado de lado esa especialidad en marzo cuando EE. UU. Comenzó a reconocer el tamaño de la amenaza del nuevo virus, cuando la ciudad de Nueva York se cerró y los CDC le dijeron a casi todos sus miles de empleados que trabajaran desde casa. Desde entonces, Chiller había sido parte del frustrante y frustrado esfuerzo de la agencia de salud pública contra COVID. Sus empleados habían estado trabajando con los departamentos de salud estatales, controlando los informes de casos y muertes y lo que las jurisdicciones debían hacer para mantenerse a salvo.
Encogiéndose de hombros por el cansancio, Chiller volvió a concentrarse en su bandeja de entrada. Enterrado en él había un boletín enviado por uno de sus empleados que lo hizo sentarse y apretar los dientes. Los hospitales cerca de Los Ángeles que estaban manejando una avalancha de COVID informaron un nuevo problema: algunos de sus pacientes habían desarrollado infecciones adicionales, con un hongo llamado Candida auris. El estado se había puesto en alerta máxima.
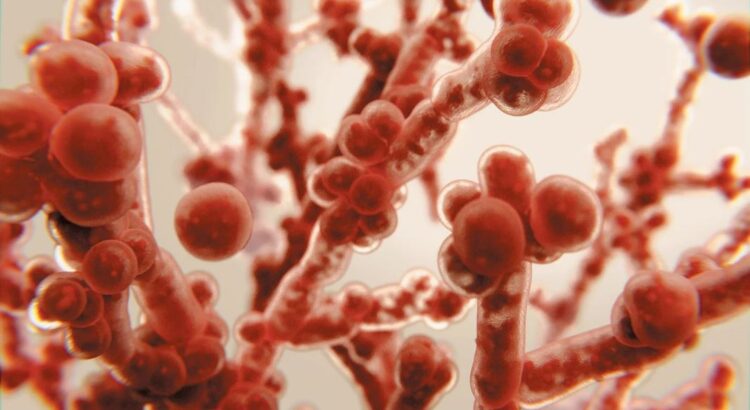
Chiller sabía todo sobre C. auris, posiblemente más que nadie en los Estados Unidos. Casi exactamente cuatro años antes, él y los CDC habían enviado un boletín urgente a los hospitales, diciéndoles que estuvieran atentos. El hongo aún no había aparecido en los EE. UU., Pero Chiller había estado charlando con compañeros en otros países y había escuchado lo que sucedió cuando el microbio invadió sus sistemas de atención médica. Resistió el tratamiento con la mayoría de los pocos medicamentos que se podían usar contra él. Prosperaba en superficies frías y duras y se reía de los productos químicos de limpieza; algunos hospitales donde aterrizó tuvieron que arrancar equipos y muros para derrotarlo. Causó brotes de rápida propagación y mató hasta dos tercios de las personas que lo contrajeron.
75.000 personas en los EE.UU son hospitalizadas por hongos cada año. 8,9 millones son atendidos de forma ambulatoria
Poco después de esa advertencia, C. auris entró en los EE. UU. Antes de finales de 2016, 14 personas la contrajeron y cuatro murieron. Desde entonces, los CDC han estado rastreando su movimiento, clasificándolo como una de las pocas enfermedades peligrosas que los médicos y los departamentos de salud tenían que informar a la agencia. A fines de 2020, se habían registrado más de 1.500 casos en los EE. UU., En 23 estados. Y luego llegó COVID, matando gente, abrumando hospitales y reorientando todos los esfuerzos de salud pública hacia el nuevo virus y lejos de otros organismos deshonestos.
Pero desde el comienzo de la pandemia, Chiller se sintió incómodo por su posible intersección con las infecciones por hongos. Los primeros informes de casos de COVID, publicados por científicos chinos en revistas internacionales, describían a los pacientes como catastróficamente enfermos y enviados a cuidados intensivos: farmacéuticamente paralizados, conectados a ventiladores, con vías intravenosas, cargados de medicamentos para suprimir la infección y la inflamación. Esas intervenciones frenéticas podrían salvarlos del virus, pero los fármacos que amortiguan el sistema inmunológico desactivarían sus defensas innatas y los antibióticos de amplio espectro matarían las bacterias beneficiosas que mantienen a raya a los microbios invasores. Los pacientes quedarían extraordinariamente vulnerables a cualquier otro patógeno que pudiera estar al acecho cerca.
Chiller y sus colegas comenzaron a comunicarse silenciosamente con colegas en los EE. UU. Y Europa, pidiéndoles cualquier señal de advertencia de que COVID estaba permitiendo que los hongos mortales se afianzaran. Las cuentas de infecciones llegaron desde India, Italia, Colombia, Alemania, Austria, Bélgica, Irlanda, Países Bajos y Francia. Ahora los mismos hongos mortales estaban apareciendo también en pacientes estadounidenses: los primeros signos de una segunda epidemia , superpuestos a la pandemia viral. Y no fue solo C. auris. Otro hongo mortal llamado Aspergillus también estaba comenzando a hacer estragos.
“Esto va a ser generalizado en todas partes”, dice Chiller. “No creemos que podamos contener esto”.
Es probable que pensemos en los hongos, si es que pensamos en ellos, como molestias menores: moho en el queso, moho en los zapatos empujados al fondo del armario, hongos que brotan en el jardín después de fuertes lluvias. Los notamos, y luego los raspamos o desempolvamos, sin percibir nunca que nos estamos comprometiendo con las frágiles franjas de una red que teje el planeta. Los hongos constituyen su propio reino biológico de alrededor de seis millones de especies diversas, que van desde compañeros comunes como la levadura para hornear hasta exóticos silvestres. Se diferencian de los otros reinos en formas complejas. A diferencia de los animales, tienen paredes celulares, no membranas; a diferencia de las plantas, no pueden producir su propia comida; a diferencia de las bacterias, mantienen su ADN dentro de un núcleo y empaquetan las células con orgánulos, características que las hacen, a nivel celular, extrañamente similares a nosotros. Los hongos rompen rocas.
Esa convivencia mutua se está desequilibrando ahora. Los hongos están surgiendo más allá de las zonas climáticas en las que vivieron durante mucho tiempo, adaptándose a entornos que alguna vez habrían sido hostiles, aprendiendo nuevos comportamientos que les permiten saltar entre especies de formas novedosas. Mientras ejecutan esas maniobras, se están convirtiendo en patógenos más exitosos, amenazando la salud humana en formas y números que antes no podían lograr.
La vigilancia que identifica infecciones fúngicas graves es irregular, por lo que es probable que cualquier número sea un recuento insuficiente. Pero una estimación ampliamente compartida propone que posiblemente haya 300 millones de personas infectadas con enfermedades fúngicas en todo el mundo y 1,6 millones de muertes cada año, más que la malaria, tantas como la tuberculosis. Solo en los EE. UU., Los CDC estiman que más de 75,000 personas son hospitalizadas anualmente por una infección por hongos, y otros 8,9 millones de personas buscan una visita ambulatoria, con un costo de alrededor de $ 7,2 mil millones al año.
Para los médicos y epidemiólogos, esto es sorprendente y desconcertante. La doctrina médica de larga data sostiene que estamos protegidos de los hongos no solo por las defensas inmunitarias en capas, sino porque somos mamíferos, con temperaturas centrales más altas de lo que prefieren los hongos. Las superficies exteriores más frías de nuestro cuerpo corren el riesgo de sufrir agresiones menores (piense en el pie de atleta, las infecciones por hongos, la tiña), pero en las personas con un sistema inmunológico sano, las infecciones invasivas han sido raras.
Eso puede habernos dejado demasiado confiados. “Tenemos un punto ciego enorme”, dice Arturo Casadevall, médico y microbiólogo molecular de la Escuela de Salud Pública Johns Hopkins Bloomberg. “Camine por la calle y pregunte a la gente a qué le tienen miedo, y le dirán que le temen a las bacterias, le temen a los virus, pero no temen morir de hongos”.
Irónicamente, son nuestros éxitos los que nos hicieron vulnerables. Los hongos explotan los sistemas inmunológicos dañados, pero antes de mediados del siglo XX, las personas con inmunidad deteriorada no vivían mucho tiempo. Desde entonces, la medicina se ha vuelto muy buena para mantener con vida a esas personas, a pesar de que su sistema inmunológico está comprometido por una enfermedad, el tratamiento del cáncer o la edad. También ha desarrollado una serie de terapias que suprimen deliberadamente la inmunidad, para mantener sanos a los receptores de trasplantes y tratar trastornos autoinmunes como el lupus y la artritis reumatoide. Ahora vive un gran número de personas que son especialmente vulnerables a los hongos. (Fue una infección por hongos, neumonía por Pneumocystis carinii , que alertó a los médicos sobre los primeros casos conocidos de VIH hace 40 años en junio de este año).
No toda nuestra vulnerabilidad es culpa de que la medicina haya preservado la vida con tanto éxito. Otras acciones humanas han abierto más puertas entre el mundo de los hongos y el nuestro. Limpiamos la tierra para cultivos y asentamientos y perturbamos lo que eran equilibrios estables entre los hongos y sus huéspedes. Transportamos mercancías y animales por todo el mundo, y los hongos hacen autostop en ellos. Empapamos los cultivos con fungicidas y mejoramos la resistencia de los organismos que residen cerca. Tomamos acciones que calientan el clima y los hongos se adaptan, reduciendo la brecha entre su temperatura preferida y la nuestra que nos protegió durante tanto tiempo.
Pero los hongos no arrasaron nuestro territorio desde algún lugar extranjero.
Siempre estuvieron con nosotros, entretejidos a través de nuestras vidas y nuestros entornos e incluso nuestros cuerpos: todos los días, cada persona en el planeta inhala al menos 1,000 esporas de hongos. No es posible aislarnos del reino de los hongos. Pero los científicos están tratando de comprender con urgencia las innumerables formas en que desmantelamos nuestras defensas contra los microbios, para encontrar mejores enfoques para reconstruirlos.
Es desconcertante que los seres humanos nos hayamos sentido tan a salvo de los hongos cuando sabemos desde hace siglos que nuestros cultivos pueden ser devastados por sus ataques. En la década de 1840, un organismo parecido a un hongo, Phytophthora infestans, destruyó la cosecha de papa irlandesa; más de un millón de personas, una octava parte de la población, murieron de hambre. (El microbio, antes considerado un hongo, ahora se clasifica como un organismo muy similar, un moho de agua). En la década de 1870, la roya de la hoja del café, Hemileia vastatrix,acabó con las plantas de café en todo el sur de Asia, reordenando por completo la agricultura colonial de India y Sri Lanka y transfiriendo la producción de café a América Central y del Sur. Los hongos son la razón por la que miles de millones de castaños estadounidenses desaparecieron de los bosques de los Apalaches en los Estados Unidos en la década de 1920 y que millones de olmos holandeses moribundos fueron talados de las ciudades estadounidenses en la década de 1940. Destruyen una quinta parte de los cultivos alimentarios del mundo en el campo cada año.
Sin embargo, durante años, la medicina observó la devastación que los hongos causan en el reino vegetal y nunca consideró que los humanos u otros animales pudieran correr el mismo riesgo. “Los fitopatólogos y los agricultores se toman los hongos muy en serio y siempre lo han hecho, y los agronegocios lo han hecho”, dice Matthew C. Fisher, profesor de epidemiología en el Imperial College de Londres, cuyo trabajo se centra en identificar las amenazas de hongos emergentes. “Pero están muy descuidados desde el punto de vista de las enfermedades de los animales salvajes y también de las enfermedades humanas”.
Entonces, cuando los gatos salvajes de Río de Janeiro comenzaron a enfermarse, nadie pensó en un principio preguntar por qué. Los gatos callejeros tienen vidas difíciles de todos modos, muerden, pelean y dan a luz interminables camadas de gatitos. Pero en el verano de 1998, decenas y luego cientos de gatos del vecindario comenzaron a mostrar horribles heridas: llagas en sus patas y orejas, ojos hinchados y nublados, lo que parecían tumores floreciendo en sus caras. Los gatos de Río viven entremezclados con los humanos: los niños juegan con ellos, y especialmente en los barrios pobres las mujeres los alientan a permanecer cerca de las casas y lidiar con ratas y ratones. Al poco tiempo, algunos de los niños y las madres también comenzaron a enfermarse. En sus manos se abrieron heridas redondas con bordes crujientes, y duros bultos rojos se arrastraron por sus brazos como si siguieran una pista.
En 2001, investigadores de la Fundación Oswaldo Cruz, un hospital e instituto de investigación ubicado en Río, se dieron cuenta de que habían tratado a 178 personas en tres años, en su mayoría madres y abuelas, por bultos similares y lesiones supurantes. Casi todos tenían contacto diario con gatos. Al analizar las infecciones y las de los gatos tratados en una clínica veterinaria cercana, encontraron un hongo llamado Sporothrix .
Las diversas especies del género Sporothrix viven en el suelo y en las plantas. Introducido en el cuerpo mediante un corte o rasguño, este hongo se transforma en una forma en ciernes que se asemeja a una levadura. En el pasado, la forma de levadura no se contagiaba, pero en esta epidemia sí lo era. Así era como los gatos se contagiaban entre sí y a sus cuidadores: las levaduras en sus heridas y la saliva volaban de gato en gato cuando peleaban, empujaban o estornudaban. Los gatos se lo transmitieron a los humanos a través de garras, dientes y caricias. Las infecciones se propagan desde la piel hasta los ganglios linfáticos y el torrente sanguíneo y hasta los ojos y los órganos internos. En los informes de casos recopilados por médicos en Brasil, hubo informes de quistes de hongos que crecían en el cerebro de las personas.
Al hongo con esta habilidad se le decretó una nueva especie, Sporothrix brasiliensis . Para 2004, 759 personas habían sido tratadas por la enfermedad en la Fundación Cruz; en 2011, el recuento llegó a 4.100 personas. Para el año pasado, más de 12,000 personas en Brasil habían sido diagnosticadas con la enfermedad en una franja de más de 2,500 millas. Se ha extendido a Paraguay, Argentina, Bolivia, Colombia y Panamá.
Una epidemia en expansión
“Esta epidemia no se detendrá”, dice Flávio Queiroz-Telles, médico y profesor asociado de la Universidad Federal de Paraná en Curitiba, quien vio su primer caso en 2011. “Se está expandiendo”.
Era un misterio cómo: los gatos salvajes deambulan, pero no migran miles de kilómetros. En el CDC, Chiller y sus colegas sospecharon una posible respuesta. En Brasil y Argentina, se ha encontrado esporotricosis tanto en ratas como en gatos. Los roedores infectados pueden subirse a los productos que se trasladan a los contenedores de envío. Millones de esos contenedores aterrizan en barcos que atracan en puertos estadounidenses todos los días. El hongo podría estar llegando a los Estados Unidos. Una rata enferma que escapó de un contenedor podría sembrar la infección en la ciudad que rodea un puerto.
“En los centros densamente poblados, donde hay muchos gatos salvajes, se podría ver un aumento en los gatos extremadamente enfermos que deambulan por las calles”, dice John Rossow, veterinario de los CDC, quien pudo haber sido el primero en notar la amenaza de Sporothrix para los EE. UU. “Y dado que los estadounidenses no podemos evitar ayudar a los animales callejeros, imagino que veremos mucha transmisión a las personas”.
Para un micólogo como Chiller, este tipo de propagación es una advertencia: el reino de los hongos está en movimiento, presionando contra los límites, buscando cualquier ventaja posible en la búsqueda de nuevos huéspedes. Y que, quizás, les estamos ayudando. “Los hongos están vivos; se adaptan ”, dice. Entre sus varios millones de especies, “hasta ahora, sólo unas 300 de las que sabemos causan enfermedades en los seres humanos. Eso es un gran potencial de novedad y diferenciación, en cosas que han existido durante mil millones de años “.
Torrence Irvin tenía 44 años cuando comenzaron sus problemas de hongos. Un hombre grande y saludable que había sido un atleta en la escuela secundaria y la universidad, vive en Patterson, California, un pueblo tranquilo en el Valle Central escondido frente a la Ruta 5 de Estados Unidos. Un poco más de dos años antes, Irvin había comprado una casa en una nueva subdivisión y se mudó con su esposa, Rhonda, y sus dos hijas. Fue gerente de almacén del minorista Crate & Barrel y locutor de partidos de fútbol juvenil locales.
En septiembre de 2018, Irvin comenzó a sentir que se había resfriado y no podía evitarlo. Se tomó una dosis de Nyquil, pero a medida que pasaban las semanas, se sentía débil y sin aliento. Un día de octubre, se derrumbó y cayó de rodillas en su dormitorio. Su hija lo encontró. Su esposa insistió en que fueran a la sala de emergencias.
Los médicos pensaron que tenía neumonía. Lo enviaron a casa con antibióticos e instrucciones para usar medicamentos de venta libre. Se debilitó y no pudo retener la comida. Acudió a otros médicos, mientras empeoraba constantemente, padecía dificultad para respirar, sudores nocturnos y una pérdida de peso similar a la de una víctima de cáncer. De 280 libras, se redujo a 150. Finalmente, una prueba arrojó una respuesta: una infección por hongos llamada coccidioidomicosis, generalmente conocida como fiebre del Valle. “Hasta que lo obtuve, nunca había oído hablar de él”, dice.
Pero otros lo habían hecho.
Irvin fue remitido a la Universidad de California en Davis, a 100 millas de su casa, que había establecido un Centro para la Fiebre del Valle. La dolencia ocurre principalmente en California y Arizona, el extremo sur de Nevada, Nuevo México y el lejano oeste de Texas. Los microbios detrás de él, Coccidioides immitis y Coccidioides posadasii, infectan a unas 150.000 personas en esa área cada año, y fuera de la región apenas se conoce la infección. “No es un patógeno nacional; no se contagia en Nueva York, Boston o DC densamente poblados”, dice George R. Thompson, codirector del centro Davis y médico que comenzó a supervisar la atención de Irvin. “Así que incluso los médicos lo ven como una enfermedad exótica. Pero en áreas donde es endémico, es muy común “.
Similar a Sporothrix, Coccidioidestiene dos formas, comenzando con una filiforme y frágil que existe en el suelo y se rompe cuando se altera el suelo. Sus componentes livianos pueden soplar con el viento durante cientos de millas. En algún lugar de su vida en el Valle Central, Irvin había inhalado una dosis. El hongo se había transformado en su cuerpo en esferas llenas de esporas que migraron a través de su sangre, infiltrándose en su cráneo y columna vertebral. Para protegerlo, su cuerpo produjo tejido cicatricial que se endureció y bloqueó sus pulmones. Cuando estuvo bajo el cuidado de Thompson, siete meses después de su primer colapso, respiraba con solo el 25 por ciento de su capacidad pulmonar. A pesar de lo potencialmente mortal que fue, Irvin tuvo suerte: en aproximadamente un caso de cada 100, el hongo desarrolla masas potencialmente mortales en los órganos y las membranas alrededor del cerebro.
Irvin había pasado por todos los tratamientos aprobados. Solo hay cinco clases de medicamentos antimicóticos, un número pequeño en comparación con las más de 20 clases de antibióticos para combatir las bacterias. Los medicamentos antimicóticos son tan pocos en parte porque son difíciles de diseñar: debido a que los hongos y los humanos son similares a nivel celular, es un desafío crear un medicamento que pueda matarlos sin matarnos a nosotros también.
Es tan desafiante que una nueva clase de antifúngicos llega al mercado solo cada 20 años aproximadamente: la clase de polienos, incluida la anfotericina B, en la década de 1950; los azoles en la década de 1980; y los medicamentos de equinocandina, el remedio más nuevo, a partir de 2001. (También está la terbinafina, que se usa principalmente para infecciones externas, y la flucitosina, que se usa principalmente en combinación con otros medicamentos).
Para Irvin, nada funcionó lo suficientemente bien. “Yo era un esqueleto”, recuerda. “Mi papá venía a visitarnos y se sentaba allí con lágrimas en los ojos. Mis hijos no querían verme “.
En un último esfuerzo, el equipo de Davis le consiguió a Irvin una nueva droga llamada olorofim. Se fabrica en el Reino Unido y aún no está en el mercado, pero se abrió un ensayo clínico para pacientes en los que todos los demás fármacos habían fallado. Irvin calificó. Casi tan pronto como lo recibió, comenzó a doblar la esquina. Sus mejillas se llenaron. Se puso de pie con un andador. En varias semanas, se fue a casa.
La fiebre del valle es ocho veces más común ahora que hace 20 años. Ese período coincide con una mayor migración hacia el suroeste y la costa oeste (más construcción de viviendas, más remoción del suelo) y también con aumentos en el clima cálido y seco relacionado con el cambio climático. “ Coccidioides es realmente feliz en suelo húmedo; no forma esporas y, por lo tanto, no es particularmente infeccioso ”, dice Thompson. “Durante los períodos de sequía, es cuando se forman las esporas. Y hemos tenido una gran sequía en la última década “.
Debido a que la fiebre del Valle siempre ha sido una enfermedad del desierto, los científicos asumieron que la amenaza de los hongos permanecería en esas áreas. Pero eso está cambiando. En 2010, tres personas contrajeron la fiebre del valle en el este del estado de Washington, 900 millas al norte: un niño de 12 años que había estado jugando en un cañón y respiró las esporas, un niño de 15 años que se cayó de un vehículo todo terreno y contrajo fiebre del Valle a través de sus heridas, y un trabajador de la construcción de 58 años cuya infección fue a su cerebro. La investigación publicada hace dos años muestra que estos casos podrían convertirse en una rutina. Morgan Gorris, un científico de sistemas terrestres en el Laboratorio Nacional de Los Alamos, usó escenarios de calentamiento climático para proyectar cuánto de los EE. UU. Podría convertirse en territorio amigo para Coccidioidesa finales de este siglo. En el escenario con el aumento de temperatura más alto, el área con condiciones propicias para la fiebre del Valle, una temperatura media anual de 10,7 grados Celsius (51 grados Fahrenheit) y una precipitación media anual de menos de 600 milímetros (23,6 pulgadas), llega a la frontera canadiense. y cubre la mayor parte del oeste de EE. UU.
Irvin ha pasado casi dos años recuperándose; todavía toma seis pastillas de olorifim al día y espera hacerlo de forma indefinida. Volvió a ganar peso y fuerza, pero sus pulmones siguen dañados y ha tenido que pasar por discapacidad. “Estoy aprendiendo a vivir con esto”, dice. “Estaré lidiando con eso por el resto de mi vida”.
Sporothrix encontró una nueva forma de transmitirse.
La fiebre del valle se expandió a un nuevo rango. C. auris , el hongo que se aprovechó del COVID, realizó un truco similar, explotando nichos abiertos por el caos de la pandemia.
Ese hongo ya era un mal actor. No se comportó de la forma en que lo hacen otras levaduras patógenas, viviendo en reposo en el intestino de alguien y subiendo a su sangre o membranas mucosas cuando su sistema inmunológico se desequilibró. En algún momento de la primera década del siglo, C. auris adquirió la capacidad de transmitirse directamente de persona a persona. Aprendió a vivir del metal, el plástico y las superficies rugosas de la tela y el papel. Cuando el primer ataque de COVID creó una escasez de máscaras y batas desechables, obligó a los trabajadores de la salud a reutilizar el equipo que generalmente desechan entre los pacientes para evitar portar infecciones. Y C. auris estaba listo.
En Nueva Delhi, el médico y microbiólogo Anuradha Chowdhary leyó los primeros informes de casos y estaba nervioso de que el COVID parecía ser una enfermedad tanto inflamatoria como respiratoria. La respuesta médica de rutina a la inflamación sería amortiguar la respuesta inmune del paciente, usando esteroides. Eso haría que los pacientes fueran invadidos por hongos, se dio cuenta. C. auris , letal y persistente, ya se había identificado en hospitales de 40 países de todos los continentes, excepto la Antártida. Si los trabajadores de la salud transportaran sin saberlo el organismo a través de sus hospitales en ropa reutilizada, habría una conflagración.
“Pensé: ‘Oh, Dios, las UCI estarán sobrecargadas de pacientes y las políticas de control de infecciones se verán comprometidas’”, dijo recientemente. “En cualquier UCI donde C. auris ya está presente, va a causar estragos”.
Chowdhary publicó una advertencia a otros médicos en una revista médica al comienzo de la pandemia. A los pocos meses, escribió una actualización: una UCI de 65 camas en Nueva Delhi había sido invadida por C. auris , y dos tercios de los pacientes que contrajeron la levadura después de ser admitidos con COVID murieron. En los EE. UU., El boletín que recibió Chiller señaló varios cientos de casos en hospitales e instalaciones de atención a largo plazo en Los Ángeles y el cercano condado de Orange, y un solo hospital en Florida reveló que albergaba 35. Donde había unos pocos, los CDC supusieron que había más, pero que las pruebas de rutina, su visión de ojo de cerradura en la propagación sigilosa del organismo, había sido abandonada por el exceso de trabajo de cuidar a los pacientes pandémicos.
Especies de hongos estimadas: 5 millones. Número conocido por causar enfermedades humanas: 300
Por muy malo que fuera, los médicos familiarizados con los hongos estaban atentos a una amenaza mayor: la amplificación de otro hongo al que COVID podría dar una ventaja.
En la naturaleza, Aspergillus fumigatus sirve como equipo de limpieza. Fomenta la descomposición de la vegetación, evitando que el mundo se sumerja en plantas muertas y hojas otoñales. Sin embargo, en medicina, se conoce al Aspergillus como la causa de una infección oportunista que se genera cuando un sistema inmunológico humano comprometido no puede eliminar sus esporas. En las personas que ya están enfermas, la tasa de mortalidad por aspergilosis invasiva ronda el 100 por ciento.
Durante la pandemia de gripe aviar H1N1 de 2009, Aspergillus comenzó a encontrar nuevas víctimas, personas sanas cuya única enfermedad subyacente era la influenza. En los hospitales de los Países Bajos, una serie de pacientes con gripe llegaron sin poder respirar y en estado de shock. En días, murieron. Para 2018, lo que los médicos llamaban aspergilosis pulmonar invasiva estaba ocurriendo en uno de cada tres pacientes críticamente enfermos de gripe y matando hasta dos tercios de ellos.
Entonces llegó el coronavirus. Limpió la superficie interior del pulmón como lo hace la gripe. Las redes de advertencia que vinculan a médicos y micólogos de enfermedades infecciosas de todo el mundo se iluminaron con relatos de aspergilosis que afectaban a pacientes afectados por COVID: en China, Francia, Bélgica, Alemania, los Países Bajos, Austria, Irlanda, Italia e Irán. Tan desafiante como lo fue C. auris como complicación, Aspergillus fue peor. C. auris acecha en los hospitales. El lugar donde los pacientes estaban expuestos a Aspergillus estaba, bueno, en todas partes. No había forma de eliminar las esporas del medio ambiente o evitar que la gente las inhalara.
En Baltimore, el médico Kieren Marr estaba muy consciente del peligro. Marr es profesor de medicina y oncología en el Centro Médico Johns Hopkins y dirige su unidad sobre trasplantes y enfermedades infecciosas oncológicas. Las infecciones que se apoderan de las personas que han recibido un órgano nuevo o un trasplante de médula ósea son un territorio familiar para ella. Cuando llegó el COVID, le preocupaba que aumentara el Aspergillus y que los hospitales de EE. UU., Si no estaban alertas a la amenaza, no lo detectarían. Johns Hopkins comenzó a evaluar a los pacientes con COVID en su UCI con el tipo de pruebas de diagnóstico molecular que se usan en Europa, tratando de ponerse al día con la infección a tiempo para tratar de tratarla. En los cinco hospitales que opera el sistema Johns Hopkins, se encontró que una de cada 10 personas con COVID grave estaba desarrollando aspergilosis.
Varios pacientes murieron, incluido uno cuya aspergilosis se fue al cerebro. Marr temía que hubiera muchos otros pacientes como ese, en todo el país, cuya enfermedad no se detectaba a tiempo. “Esto es malo”, dijo Marr esta primavera. “ Aspergillus es más importante en COVID en este momento que C. auris. Sin duda.”
El desafío de contrarrestar los hongos patógenos no es solo que son virulentos y furtivos, por malos que sean esos rasgos. Es que los hongos se han vuelto muy buenos para protegerse de las drogas que usamos para tratar de matarlos.
La historia es similar a la de la resistencia a los antibióticos. Los farmacéuticos juegan un juego de salto, tratando de adelantarse a las maniobras evolutivas que utilizan las bacterias para protegerse de las drogas. Para los hongos, la historia es la misma pero peor. Los hongos patógenos ganan resistencia contra los agentes antifúngicos, pero hay menos medicamentos para empezar, porque la amenaza se reconoció hace relativamente poco tiempo.
“A principios de la década de 2000, cuando pasé de la academia a la industria, la línea de productos antimicóticos era cero”, dice John H. Rex, médico y defensor desde hace mucho tiempo del desarrollo de antibióticos. Rex es el director médico de F2G, que fabrica el medicamento aún no aprobado que tomó Torrence Irvin. “No había antifúngicos en ningún lugar del mundo en desarrollo clínico o incluso preclínico”.
Ese ya no es el caso, pero la investigación es lenta; al igual que con los antibióticos, las recompensas económicas de llevar un nuevo fármaco al mercado son inciertas. Pero desarrollar nuevos medicamentos es fundamental porque los pacientes pueden necesitar tomarlos durante meses, a veces durante años, y muchos de los antifúngicos existentes son tóxicos para nosotros. (La anfotericina B recibe el nombre de “agitar y hornear” por sus extenuantes efectos secundarios). “Como médico, está tomando la decisión de lidiar con una infección por hongos a costa del riñón”, dice Ciara Kennedy, presidenta y directora ejecutiva de Amplyx Pharmaceuticals, que tiene un nuevo antifúngico en desarrollo. “O si no me ocupo de la infección por hongos, sabiendo que el paciente va a morir”.
El desarrollo de nuevos medicamentos también es fundamental porque los existentes están perdiendo su eficacia. Irvin terminó en el ensayo de olorofim porque su fiebre del Valle no respondió a ningún fármaco disponible. C. auris ya muestra resistencia a los fármacos de las tres principales clases de antifúngicos. El Aspergillus ha ido acumulando resistencia al grupo antifúngico más útil para tratarlo, conocido como azoles, porque está expuesto a ellos de manera persistente. Los azoles se utilizan en todo el mundo, no solo en la agricultura para controlar las enfermedades de los cultivos, sino también en pinturas, plásticos y materiales de construcción. En el juego de salto, los hongos ya están al frente.
La mejor forma de contrarrestar los estragos de los hongos no es el tratamiento, sino la prevención: no los medicamentos, sino las vacunas. En este momento no existe ninguna vacuna para ninguna enfermedad fúngica. Pero la dificultad de tratar a los pacientes a largo plazo con medicamentos tóxicos, combinada con un asombroso número de casos, hace que sea urgente encontrar uno. Y por primera vez, uno podría estar a la vista si no al alcance.
La razón por la que las tasas de fiebre del Valle no son peores de lo que son, cuando el 10 por ciento de la población estadounidense vive en el área endémica, es que la infección confiere inmunidad de por vida. Eso sugiere que una vacuna podría ser posible, y desde la década de 1940 los investigadores lo han estado intentando. Un prototipo que usaba una versión muerta de la forma que Coccidioides toma dentro del cuerpo —esferas de hongos llenas de esporas— funcionó de manera brillante en ratones. Pero fracasó estrepitosamente en humanos en un ensayo clínico en la década de 1980.
“Lo hicimos con muy poco dinero y todos querían que funcionara”, dice John Galgiani, ahora profesor y director del Centro de Excelencia de la Fiebre del Valle de la Facultad de Medicina de la Universidad de Arizona, que formó parte de esa investigación hace 40 años. “Incluso con [malas] reacciones y el estudio que duró tres años, conservamos al 95 por ciento de las personas que se inscribieron”.
Entran perros.
Tienen la nariz metida en la tierra todo el tiempo, y eso los pone en mayor riesgo de contraer la fiebre del Valle que los humanos. En varios condados de Arizona, cerca del 10 por ciento de los perros contraen la enfermedad cada año, y es más probable que desarrollen formas graves de bloqueo pulmonar que los humanos. Sufren terriblemente y es largo y costoso tratarlos. Pero la vulnerabilidad de los perros, más los estándares más bajos que las agencias federales requieren para aprobar medicamentos para animales en comparación con los humanos, los convierte en un sistema modelo para probar una posible vacuna. Y la pasión de los dueños por sus animales y su voluntad de vaciar sus billeteras cuando pueden puede convertir la posibilidad en realidad por primera vez.
Galgiani y su grupo de Arizona ahora están trabajando en una nueva fórmula de vacuna, gracias a las donaciones financieras de cientos de dueños de perros, además de un impulso de una subvención de los Institutos Nacionales de Salud y la asistencia comercial de una empresa de California, Anivive Lifesciences. Las pruebas no están completas, pero podrían llegar al mercado para su uso en perros el próximo año. “Creo que esta es una prueba del concepto de una vacuna contra los hongos: tenerla en uso en perros, ya que es segura”, dice Lisa Shubitz, veterinaria y científica investigadora del centro de Arizona. “Realmente creo que este es el camino hacia una vacuna humana”.
Esta inyección no depende de un hongo muerto de la fiebre del Valle. En su lugar, utiliza una versión viva del hongo del que se ha eliminado un gen que es clave para su ciclo reproductivo, CPS1 . La pérdida significa que los hongos no pueden propagarse. El gen fue descubierto por un equipo de fitopatólogos y más tarde fue identificado en Coccidioides por Marc Orbach de la Universidad de Arizona, quien estudia las interacciones huésped-patógeno. Después de crear un Coccidioides mutantecon el gen eliminado, él y Galgiani infectaron experimentalmente ratones de laboratorio criados para ser exquisitamente sensibles al hongo. El microbio provocó una fuerte reacción inmune, activando las células auxiliares T tipo 1, que establecen una inmunidad duradera. Los ratones sobrevivieron durante seis meses y no desarrollaron ningún síntoma de la fiebre del Valle, a pesar de que el equipo intentó infectarlos con Coccidioides inalterados . Cuando los investigadores realizaron la autopsia de los ratones al final de ese período de medio año, los científicos no encontraron casi ningún hongo creciendo en sus pulmones. Esa protección duradera contra la infección hace que el hongo con genes eliminados sea la base más prometedora para una vacuna desde el trabajo de Galgiani en la década de 1980. Pero convertir una vacuna desarrollada para perros en una que podría usarse en humanos no será rápido.
La fórmula canina está bajo el control del Departamento de Agricultura de EE. UU., Pero la Administración de Alimentos y Medicamentos de EE. UU. Supervisaría la aprobación de una versión humana. Requeriría ensayos clínicos que probablemente se extenderían durante años e involucrarían a miles de personas en lugar de la pequeña cantidad de animales utilizados para validar la fórmula en perros. A diferencia del prototipo de la década de 1980, la nueva vacuna involucra un organismo vivo. Debido a que nunca se ha aprobado una vacuna fúngica, no existe una vía de evaluación preestablecida que los desarrolladores o las agencias reguladoras puedan seguir. “Estaríamos volando el avión y construyéndolo al mismo tiempo”, dice Galgiani.
Él estima que lograr una vacuna contra la fiebre del Valle para las personas podría llevar de cinco a siete años y alrededor de $ 150 millones, una inversión realizada contra una promesa incierta de ganancias. Pero un complejo exitoso podría tener una amplia utilidad, protegiendo a los residentes permanentes del suroeste, así como al personal militar en 120 bases y otras instalaciones en el área endémica, además de cientos de miles de migrantes “pájaros de las nieves” que visitan cada invierno. (Hace tres años, los CDC identificaron casos de fiebre del valle en 14 estados fuera de la zona endémica. La mayoría eran habitantes del suroeste de invierno que fueron diagnosticados después de regresar a casa). Según una estimación, una vacuna podría ahorrar potencialmente $ 1.5 mil millones en salud. -Costes de atención cada año.
“No veía la posibilidad de que tuviéramos una vacuna hace 10 años”, dice Galgiani. “Pero creo que ahora es posible”.
Si se logra una vacuna fúngica, abriría el camino para otra. Si las inmunizaciones tuvieran éxito, científicamente, como objetivos de la regulación y como vacunas que la gente estaría dispuesta a aceptar, ya no necesitaríamos estar en guardia constante contra el reino de los hongos. Podríamos vivir junto a él y dentro de él, con seguridad y confianza, sin temor a los estragos que pueda causar.
Pero faltan años para eso y los hongos se están moviendo ahora mismo: cambiando sus hábitos, alterando sus patrones, aprovechando emergencias como el COVID para encontrar nuevas víctimas. En el CDC, Chiller está preocupado.
“Los últimos cinco años realmente sentimos como si estuviéramos despertando a un fenómeno completamente nuevo, un mundo de hongos al que simplemente no estábamos acostumbrados”, dice Chiller. “¿Cómo nos mantenemos al tanto de eso? ¿Cómo nos cuestionamos para buscar lo que vendrá después? Estudiamos estas emergencias no como un ejercicio académico, sino porque nos muestran lo que podría venir. Necesitamos estar preparados para más sorpresas”.
Por Maryn McKenna. Artículo en inglés
 Users Today : 91
Users Today : 91 Total Users : 35460108
Total Users : 35460108 Views Today : 112
Views Today : 112 Total views : 3418743
Total views : 3418743